Меланома представляет собой наиболее агрессивную форму рака кожи. По данным Всемирной организации здравоохранения (ВОЗ), ежегодно в мире выявляется около 132 тысяч новых случаев болезни. Основой ее лечения служат иссечение, лучевая и химиотерапия, которые, однако, ненадежны и обладают побочными эффектами. Альтернативой выступает иммунотерапия. Она опирается на способность Т-клеток распознавать патогены с помощью «ощупывания» человеческих лейкоцитарных антигенов I и II классов (HLA I и II) на мембране антигенпрезентирующих клеток с помощью белков CD8 (у T-киллеров) и CD4 (у T-хелперов) соответственно. В норме узнавание на HLA чужеродного агента запускает гибель несущей его клетки.
Однако высокое мутантное давление, характерное, в частности, для меланомы, не позволяет приобретенному иммунитету предотвращать разрастание пораженных тканей. Чтобы повысить узнаваемость дефектных клеток, ученые разрабатывают персонализированные пептидные вакцины. Метод заключается в синтезе пептидных неоантигенов — белков, специфичных для опухоли конкретного человека, — на основе секвенирования генома его раковых клеток. После смешения с адъювантом (препаратом, усиливающим иммунную реакцию) их многократно вводят пациенту для формирования ответа. Сравнительно высокие безопасность, доступность и эффективность делают такие вакцины перспективным направлением онкотерапии.
Несмотря на то, что персонализированные вакцины уже показывали способность провоцировать специфические иммунные реакции у человека, их противораковые свойства оставались не доказаны. Чтобы восполнить пробел, немецкая компания BioNTech в 2013 году начала клинические исследования пептидных неоантигенов на пациентах с прогрессирующей меланомой. Теперь две независимые группы ученых сообщили о результатах фазы I этих испытаний. Первая работа предполагала создание вакцины с РНК, кодирующими до десяти опухолевых неоантигенов для каждого из 13 пациентов с меланомой 3–4-й стадии. Препараты вводились от восьми до 12 раз в область паховых лимфоузлов в течение 43 дней.
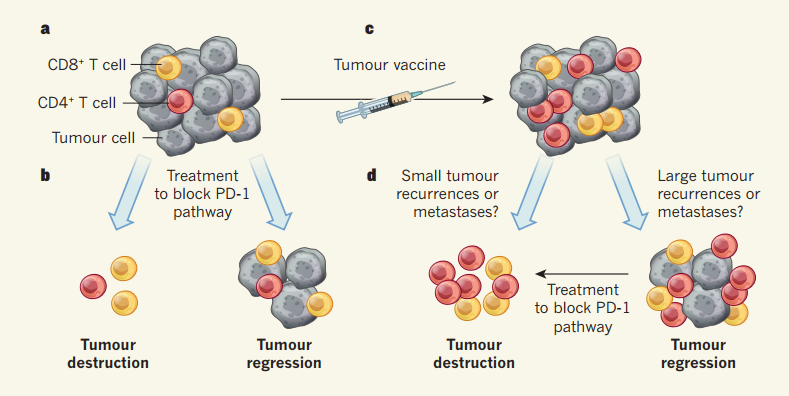
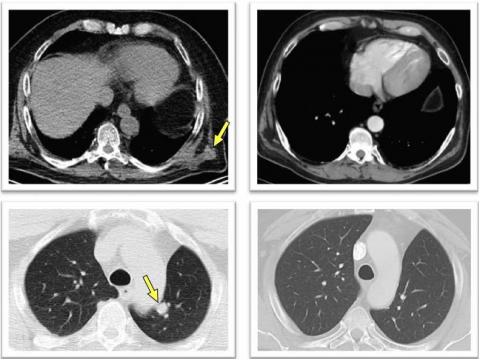
Дальнейшие анализы подтвердили, что в течение 12-23 месяцев у восьми из испытуемых наблюдалась ремиссия. Остальные столкнулись с рецидивом болезни; добиться регрессии опухоли у девятого пациента удалось путем блокировки сигнального пути PD1 — белка, активация которого подавляет Т-лимфоциты. Образцы одного из участников позволили прийти к выводу, что неудача может быть связана с нарушением экспрессии HLA I — этому соответствовали и расчеты. Кроме того, известно, что многие раковые клетки несут именно этот класс молекул и чувствительны к цитотоксичности T-киллеров. Вместе с тем более сильный иммунный ответ провоцировали препараты, нацеленные на HLA II и T-хелперы.
Схожим образом на вклад HLA II указало второе исследование. Участие в нем приняли шесть пациентов с меланомой 3–4-й стадии после операции, которым в течение 20 недель семь раз (пять первичных, два бустерных) вводили пул из четырех разных пептидов, состоявших из не более чем 20 неоантигенов. Инъекции делали в конечности или брюшную полость. Спустя 32 месяца опухоли четырех испытуемых регрессировали, у остальных эффект, как и в первом случае, был достигнут курсом пембролизумаба — ингибитора PD1. Таким образом, фаза I испытаний пептидных вакцин признана успешной. Ожидается, что это привлечет к тестам новые научно-исследовательские группы и ускорит совершенствование метода.
Ученые отмечают, что проведенные исследования имеют ряд недостатков. Так, на надежность выводов могли повлиять небольшой объем выборок и отсутствие контрольных пациентов. Кроме того, синтез пептидов занял у авторов более трех месяцев (долго для пациентов в терминальных состояниях) и неясно, можно ли адаптировать подход к типам рака, которые не отличаются высоким мутантным давлением. В отличие от меланомы, последние не предусматривают многообразия дефектов, чем резко ограничивают возможные комбинации препаратов.